Qu'est-ce que le Gans ? (Gaz à l'état de nano-particule)

Les Gans sont les atomes d'un élément chimique totalement dépourvu de liaisons, ce qui les rend très réceptifs à l'environnement et aux énergies magnéto-gravitationnelles qui y sont diffusées.
D'une certaine façon, ils ont des caractéristiques semblables à celles des gaz nobles, mais ils représentent ce que nous pourrions appeler un nouvel état de la matière.
Certains atomes et molécules libèrent et/ou absorbent des champs magnétiques et/ou gravitationnels. Les champs libérés sont disponibles pour être absorbés par d'autres molécules. La Fondation
Keshe a mis au point un moyen d'introduire ces champs libres dans l'environnement dans une substance utilisable que Keshe a appelée GANS.
Un organisme, par exemple, va émettre des champs dont il veut se débarrasser et absorber des champs qu'il peut utiliser ou dont il a un besoin urgent. La condition préalable est que les champs
d'absorption appropriés soient disponibles dans l'environnement immédiat de l'organisme.
Différents types de GANS peuvent être créés avec différentes propriétés énergétiques souhaitables qui peuvent être utilisées individuellement ou en combinaison pour différentes applications.
Chaque type de GANS a une intensité de champ spécifique qui dépend des éléments du plasma à l'intérieur du GANS. L'utilisation de différents GANS avec des intensités de champ différentes ou
l'utilisation de doubles nano-bobines avec des batteries plasma provoque un flux direct du champ des champs les plus forts vers les plus faibles.
Si ces flux de champ sont dirigés à travers un organisme, l'organisme a la possibilité d'absorber les parties nécessaires de ces flux de champ ou de libérer un surplus de champs dans
l'environnement ou peut être recueilli dans un GANS utilisable.
Grâce à cette technologie, les pouvoirs d'auto-guérison du corps sont soutenus au niveau des champs qui construisent l'organisme lui-même. Par conséquent, il n'est pas nécessaire d'avoir recours
à des agents et à des procédés chimiques puisque la cicatrisation se produit au niveau de l'interaction du champ magnétique.
Usages Médicaux et Biologiques des Gans de CO2 et CuO
Transcription de la présentation:
1 - Usages Médicaux et Biologiques des Gans de CO2 et CuO
Le nouvel état de la matière est expliqué par le physicien nucléaire Keshe dans son papier du 6/1/10 : l’absorption des gaz de CO2 et CH3 directement
de l’environnement et leur conversion en solution nano et matières nano solides, production d’énergie et d’oxygène par l’utilisation de composants nano à température et pression ambiantes.
2 - Décontamination de l’eau par utilisation d’eau de Gans énergétisée de
CuO
1.Réduire DOB ( Demande en Oxygène Biochimique).
2. Supprimer les solides en suspension.
3. Supprimer les Nitrates toxiques Gans de CuO.
3 - Décontamination de l’eau par utilisation d’eau de Gans énergétisée de CuO
Montage expérimental : Ajout de Gans Eau départ Mélange Filtrer Ajout d’eau de Gans énergétisée de CuO Après 24 heures Après 12 heures Après 6 heures Agiter
4 - Départ Après 6 heures, 12 heures, 24 heures, Lieu du prélèvement DOB Solides en suspension Nitrates Inokashira Pond mg/litre mg/litre mg NO3/litre Tokyo Ouest Japon Avant , , ,9 Après , , ,41 Elimination %
5 - Usages médicaux des Gans
6 - Comment préparer des poudres de Gans pharma de qualité
Préparation de poudre de Gans de CO2 pour administration orale
1. Placer une plaque de Cu nano enrobé et une plaque de Zn dans un conteneur plastique
2. Les relier avec un fil comme indiqué par Keshe
3. Préparer 5 Moles de solution de NaOH ( soude caustique) et la chauffer à 60°
4. Verser la solution dans le conteneur ( réacteur)
5. Placer le réacteur dans un bain d’eau et garder la température à 60°(solution dans le réacteur)
6. Après 24 heures, retirer le réacteur du bain d’eau et laisser refroidir à la température ambiante de la pièce
7. Transférer le précipité dans une centrifugeuse de 50ml et centrifuger à 10000tours/mn pendant 10mn
8. Après centrifugation, remplacer le milieu réactif avec la même quantité de MilliQ
9. Passer aux ultrasons ( vol= 3L, sortie du pic US à 320W, Fréquence à 35Khz. L’énergie appliquée par volume (poids) de nano matériaux a été estimée être de 4,8 Kjoules pour 50ml de particules ( 0,4g). Répéter les étapes 7,8 et 9 quatre fois respectivement
10. Après le 4ème cycle de lavage, sécher les particules à 80° (air) et pression atmosphérique.
11. Réduire manuellement en poudre avec un pilon ou mortier.
12. Ultérieurement sécher la poudre ( POUDRE GANS) dans une étuve à vide à 60° sous 20kPa (kilo Pascal=unité de pression atmosphérique) pendant 2 heures.
7 - Préparation de poudre de Gans de CO2 pour administration intra
veineuse
1. Placer une plaque de Cu nano enrobé et une plaque de Zn dans un conteneur plastique
2. Les relier avec un fil comme indiqué par Keshe
3. Préparer 5 moles de solution de NaOH ( soude caustique) et la chauffer à 60°
4. Verser la solution dans le conteneur ( réacteur)
5. Placer le réacteur dans un bain d’eau et garder la température à 60°( solution dans le réacteur)
6. Après 24 heure, retirer le réacteur du bain d’eau et laisser refroidir à la température ambiante de la pièce
7. Transférer le précipité dans une centrifugeuse de 50ml et centrifuger à 10000tours/mn pendant 10mn
8. Après centrifugation, remplacer le milieu réactif avec la même quantité de MilliQ
9. Passer aux ultrasons ( vol= 3L, sortie du pic US à 320W, Fréquence à 35Khz. L’énergie appliquée par volume (poids) de nano matériaux a été estimée être de 4,8 Kjoules pour 50ml de particules ( 0,4g). Répéter les étapes 7,8 et 9 quatre fois respectivement
10. Après le quatrième lavage, filtrer le mélange avec un filtre papier quantitatif, sans cendres, 8-10 micons
11. Poursuivre la filtration du médium en utilisant une membrane ultra filtrante (HFU- 2020N) taille nominale des pores 100nm et ajuster la concentration selon la concentration désirée.
8 Eau de Gans CO2 contre les dommages induits d’H²O² dans l’ADN mitochondrial (mtDNA) des fibroblastes dermiques. La rupture des brins des mtADN engendrée par le traitement H2O2 forme des comètes comme des nucléotides dans des conditions d’électrophorèse. L’ajout d’eau de Gans CO2 (250µMoles) fournit une protection complète contre les dommages induits par le H2O2 (10µM) dans les cellules fibroblastes dermiques chez l’homme (HDFn) Mitochondries dermiques.
9 Eau de Gans contre
le Cancer
Pièce de 100 Japon pour comparer dimension 26/ / Dosage 5mg/K Dimension des particules en suspension dans
l’eau de Gans Max:160nm Souris témoin Souris traitée Injection sous cutané de 1ml dans une partie cancéreuse/jour
Nourriture journalière pour rongeur
10 Test de Toxicité du CO2 in Vivo - Toxicité du Gans CO2 sur des
souris traitées en intraveineuse
Période expérimentale : 14 novembre Décembre 2016 Gans administré en intraveineuse : Total de 65 souris IRC en 7 groupes - 5 souris dans chaque
Matériel de test: Dispersion des Gans CO2 NPs en poudre < dimension des particules 100 np DLS) < 35avg,dimension.parts dans l’eau (type de modification cationic
3-Aminoprppyl triethoxysilane, avant injection intraveineuse, la dilution a été faite avec de l’eau distillée pour l’agrégation. Test animal: Souris ICR femelles âgées de
huit semaines (B.W ,ég) qui ont été achetées au CLEA( Tokyo, Japon) étaient logées par deux dans des cages par cycles de 12h lumière/noir avec un accès non limité à la nourriture pour souris et
eau. On leur a permis de s’acclimater à l’environnement pendant une semaine avant le traitement. LD50 estimation: L’estimation du LDS 50 a été extraite selon la méthode
Lichtfield-Wilcoxon. Un total de 65 souris ont été soumises à des doses NPS( nanoparticules) de Gans CO21400, 13200, 1200, 1000, 500, 250, 100, 5,1,05, et 0,1 mg/kg via une veine caudale. Après
l’injection les symptômes et la mortalité ont été observés. Accumulation cellulaire: Une seule dose intraveineuse a été fixée à 10% de formol pour une routine du process
histologique. Les souris ont reçu une seule dose Les souris ont reçu une seule dose intraveineuse par voie caudale. Les souris ont été sacrifiées au temps déterminés( 1h, 1 jour, 3 jours, 6 et 16
jours. Les prélèvements tissulaires effectués ( foie, rein, rate)
11 Résultats Estimation du LDS: pour obtenir le LDS dans le LCR des souris 1400,1300,1200,1100,1000, 500,250,100, 50, 5,1, 0,5 et 0,5 mg/Kg ont été exposée à des NPS de Gans CO2 au LCR de souris par voie intraveineuse céphalique. Le LDS du LCR a été déterminé au taux de 1400mg/Kg par injection. Cinétique du sang: basée sur le LD50, une dose de 1000mg/Kg de NPs de Gans CO2 fut utilisée. La concentration de Gans CO2 montrait une pointe à 5mn et décroissait rapidement au bout de 15mn, le changement était plus modéré au temps suivant. Durant l’expérience, aucune hémolyse notoire fut observée. En fonction du temps le niveau de Gans sanguin suivants les doses intraveineuses administrées (1000mg/Kg) à la souris. Les données présentées ont augmenté les niveaux de Gans après soustraction du niveau de Gans du groupe contrôle. Données représentées signifient +ou- SD(n=5) En fonction du temps le niveau de Gans sanguin suivants les doses intraveineuses administrées (1000mg/Kg) à la souris. Les données présentées ont augmenté les niveaux de Gans après soustraction du niveau de Gans du groupe contrôle. Données représentées signifient +ou- SD(n=5)
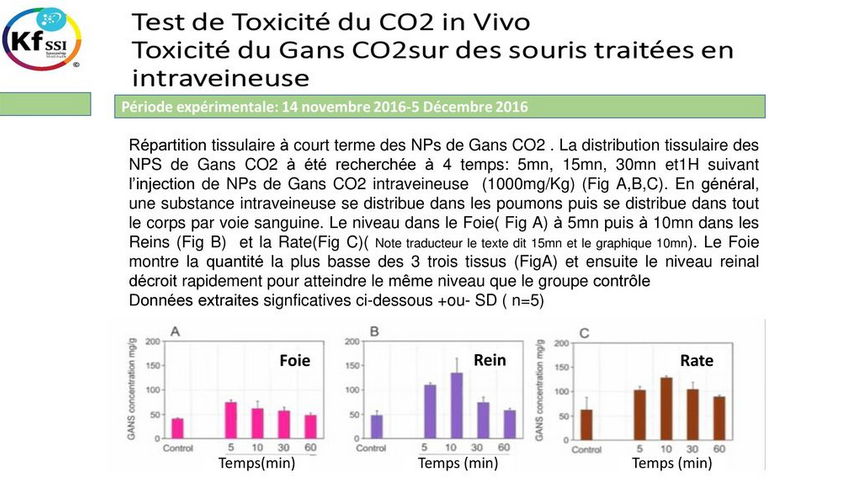
12 Répartition tissulaire à court terme des NPs de Gans CO2
Répartition tissulaire à court terme des NPs de Gans CO2 . La distribution tissulaire des NPS de Gans CO2 à été recherchée à 4 temps: 5mn, 15mn, 30mn et1H suivant l’injection de
NPs de Gans CO2 intraveineuse (1000mg/Kg) (Fig A,B,C). En général, une substance intraveineuse se distribue dans les poumons puis se distribue dans tout le corps par voie sanguine. Le niveau dans
le Foie( Fig A) à 5mn puis à 10mn dans les Reins (Fig B) et la Rate(Fig C)( Note traducteur le texte dit 15mn et le graphique 10mn). Le Foie montre la quantité la plus basse des 3 trois tissus
(FigA) et ensuite le niveau reinal décroit rapidement pour atteindre le même niveau que le groupe contrôle Données extraites signficatives ci-dessous +ou- SD ( n=5)
Foie Rein Rate Temps(min) Temps (min) Temps (min)
13 Contrôle 16 Jours 6 Jpour 3 Jours 1 jour
Examen Pathologique: Aucun changement pathologique n’a été observé dans le Foie, Reins, Rate des souris. Une seule dose de 1000mg/kg Contrôle
16 Jours 6 Jpour 3 Jours 1 jour F O I E
R E I N R A T E
14 Conclusion: La cinétique du sang et la distribution tissulaire d’une dose toxique de NPs de Gans CO2 a été investigué suivant une exposition à des souris par intra veineuse. Suivant l’injection, les NPs de Gans de CO2 ont rapidement disparu du sang et se sont distribuées dans différents organes. Le bref temps de distribution tissulaire ont montré que la Rate, le Foie et les Reins ont été les organes cibles des NPs de Gans CO2 et aucun dommage pathologique n’a été observé chez les souris exposées aux NPs de Gans CO2. Le LD50 dans l’ICR des souris était de 1500 mg/kg par injection, ce qui signifie que les NPs de Gans CO2 est pratiquement non toxique.
15 Efficacité anti cancer des particules de Gans CO2 et ZnO in Vitro
Propriétés des particules de Gans sur les cellules cancéreuses humaines (HepG2, A549, et BEAS-B2) Matériel de Test: NPs de Gans et Amine= CH3
« contenant de l’eau » Reactif: sérum de fœtus bovin, penicilline- streptomicine, support DMEM/F-12, support RPM1640, et solution phosphate Dulbecco’s ssaline
tampon ont été achetées chez Nocolai Tesque (Kyoto, Japon). Anticorps anti-p3, anticorps antibax, anticorps anti-bcl2, anticorps anti béta-actine, ont été obtenu auprès de IBL Takasaki,Jajon. Les
anti corps secondaires les tampons RIPA et dodecyle sulfate de sodium(DS) ont été acheté chez Wako Pure Chemical Industry (Osaka,Japon). MTT( 3- (4,5 diméthylthiasol-2-yl)-2,5
dyphényltetrazoliumbromide,GSH, 5,5-dithio-(2-acide nitrobenzoique) (DTNB), acide thiobarbiturique (TBA), 2,7- dychlorofluorecine idacétate ( DCFH-DA) ont été acheté auprès de Sigma-Aldrich. Tous
les autres poroduits chimioques nutilisés provenaient de sources commerciales de très hautes qualités pures. Analyse des dimensions des NPs de Gans CO2 et ZnO: La
dimension moyenne hydrodynamique et le potentiel Zeta des NPS de Gans dans l’eau et le support de cellule entières ont été déterminé par lumière dynamique diffuse (DLS) (Horiba LB 550,
Horiba,Japon). Les deux Gans CO2 et ZnO ont été dispersés dans l’eau et le support de cellules entières à une concentration respective de 15µg/mL et 0,1µg/mL pendant 24H. Ensuite la suspension a
été ultra sonnée dans un bain à ultrasons à température ambiante à 40W et le DLS a été effectué.
16 Efficacité anti cancer des particules de Gans CO2 et ZnO in Vitro
Culture cellulaire et exposition aux NPs de Gans CO2 et ZnO: 3 types de cellules cancéreuses HepG2,A549, et BEAS-B2 et deux cellules primitives de rat (astrocytes et hépatocytes)
ont été utilisées pour déterminer la viabilité des cellules en regard d’une exposition aux NPS de Gans CO2 et ZnO. Les cellules carcinome hépatique ( HepG2, cellules humaines épithéliales
bronchiques BEAS-B2 ont été obtenues auprès de « Collection Culture Type Américaine »(Rockville, MD, USA) et les cellules adénocarcinome humaines ont été achetées à la Banque Ressource
Cancer Japon (JRCB, Tokyo, Japon). Les hépatocytes et astrocytes de rat ont été isolées par la technique de perfusion collagénase. Les cellules ont été cultivées dans un
milieu de supplémentation DMEM/F-12 ou RPMI 1640 avec 10% de sérum fœtal bovin et 100U.ml de streptomycine et pénicilline à 5% de CO2 et 37°C. A 85% de confluence ont été récoltées en utilisant
0,25% de trypsine et ont été sous cultivées dans des flasques de 75 cm² ou des soucoupes de six ou 96 selon l’expérience sélectionnée. On a laissé les cellules se fixer pendant 24 heures avant
traitement. Les NPs de Gans CO2 et ZnO ont été mises en suspension dans le milieu de culture et dilués soit avec de l’eau soit avec un amine « reteneur d’eau » pour des concentrations
appropriées 5µg/ml, 10µg/ml, 15µg/ml) pour les NPS de Gans CO2 et 0,025µg/ml, 0,05µg/ml, 0,1µg/ml) pour les NPs de ZnO. Les dilutions de NPs ont ensuite été ulltra sonnées dans un appareil à bain
d’ultra sons à température ambiante 10mn à 40W pour éviter toute agglutination avant l’exposition aux cellules. A al suite du traitement les cellules ont été récoltées pour déterminer la
cytotoxicité, le stress oxydatif, et les marqueurs d’apoptose. Les cellules non exposées aux NPs de Gans ont servi de contrôle pour chaque expérimentation.
17 Analyse de viabilité cellulaire: Viabilité HepG2, A549, BEAS-2B et cellules primaires de rats hépatocytes et astrocytes ont été évaluées par l’assesseur MTT. Rapidement1*104 cellules/bonnes ont germées dans 96 boites de cultures et exposées à des NPs de Gans de CO2 et ZnO soit avec de l’ eau distillée soit de l’eau avec amine « rétenseur d’eau » à des concentration de 5µg/mL, 10µg/mL, 15µg/mL et 0,25µg/mL, O,05µg/mL, 0,1µgmg/mL respectivement en 24heures. A la fin de l’exposition le support de culture a été rétiré de chaque boite pour éviter toute interférence avec les NPs de Gans et replacées avec un support contenant une solution MTT (0,5 mg/mL) pour une quantité égale à 10% du volume de culture et incubé pendant 3 heures à température de 37° jusqu’à ce qu’une couleur violette formazan se développe. La résultante de formazan produite a été dissoute dans de l’acide isopropanol. Ensuite les 96 boites de culture ont été placées en centrifugeuse à 2300*g pendant 5mn pour installer la permanence des NPs de Gans. Ensuite 100µL surnageant ont été transférées dans 96 autres boites de culture vierges et l’absorption a été à 570nm par un lecteur micro plateau (MTP-900, Coronna Electrique, Japan) Immunobuvardage: Des cellules HepG2 cancéreuse hépatiques ont été cultivées dans six boites de pétri et exposées à des Nps de Gans de CO2 et ZnO à une concentration respective de 15µg/ML et 0,1µg/ML diluées soit avec de l’eau soit de l’amine »retenseur d’eau » pendant 24heures. Les grains de cellules récoltés ont lysé avec un tampon lyse RIPA (1*TBS[0,5 Mtris-HCL et 1,5 MNaCl] pH4, 1%NP-40,05% sodium deocholate, 0,1% SDS, O,04% sodium azide,) en présence d’inhibiteur de protéase. Les cellules lysées ont été analysées pour leur contenu en protéines en utilisant SDS page d’immunobuvardage. La membrane a alors été examinée avec p53, bax, bcl-2, et béta-actine anti corps pour déterminer l’expression des protéines.
18 Analyse du RNA (Acide Ribo Nucléique) Total et quantité PCR en temps réel des marqueurs d’apoptose: les cellules cancéreuses humaine HepG2 ont été cultivées dans coupelles de 6 et soumisent à 15µg/ml de NPs de Gans CO2 et 0,1µg/ml de NPs de Gans ZnO soit dilué avec de l’eau soit avec un amine « reteneur d’eau », pendant 24heures. A la fin de l’exposition, la totalité de RNA a été extraite avec un tissu Kit SP RNA ( Kurabo, Japon) selon les instruction du fabriquant. La concentration extraite de RNA a été déterminée en utilisant le spectrophotomètre UV-1800 (Shimadzu,Japon) et l’intégrité du RNA a été visualisée sur un gel agarose à 1% en utilisant la documentation du système gel (AE-6933FXES, Atto, Japon). La prmière couche de cDNA a été synthétisée à partir de 1µg d’un de RNA total par transcription inversée en utilisant M-MLV ( Rever-Tra-Ace-alpha, Toyobo Life Science, Japon) et amorce oligo 5Dt) selon le protocole du fabricant. Le PCR quantitatif en temps réel a été effectué par SYBR*Vert Temps Réel PCR Master Mix ( Toyobo, Life Science, Japon) en utilisant un PRISME ABI 7000 Séquence Détection Système (Applied, CA, USA). Deux micro filtre de modèle cDNA au volume final de 20µl de mélange réactif. Les paramètres du cycle PCR temps réel incluait 10 minutes à 95°C par 40 cycles faisant intervenir une dénaturation à 95°C pendant 15secondes, recuisson à 60°C pendant 20 secondes et élongation à 72°C pendant 20 secondes. Toutes les expérimentations en temps réel ont été réalisées en triple et les données ont été exprimées comme au moins trois expérimentations indépendantes.
19 Caspase- 3 essais: L’activité de l’enzyme caspase-3 a été déterminé en utilisant une micro plaque fluométrique stand à essai. En bref , 1*104 cellules HepG2 par assiette ont germé dans 96 coupelles et exposées à des NPs de Gans CO2 et de ZnO à des concentrations respectives de 15µg/ml et 0,1µg/ml soit dilués avec de l’eau soit avec un amine reteneur d’eau pour24 heures. Après que l’exposition ait été complète, les cellules ont été récoltées dans un tampon glacé salé de phosphate et préparée pour une lyse. Plus tard un mélange réactif contenant 30µl de cellules lysées, 20µl de Ac- DEVDAFC ( substrat de caspase-3) et 150µl de tampon réactif de protéase (50mM Herpes, 1mM de EDTA, et 1mMde DTT)(pH7,2) ont été incubées durant 15 mn. La fluorescence du milieu réactif a été mesuré à 5 minutes d’intervalles pour 15 minutes d’excitation/émission de longueur d’onde de 435/535nm en utilisant une micro plaque lectrice (MTP-900, Corona Electric, Japon). La télémétrie standard 7-amido-4trifluorométhylcoumarin allant de 5%M à 15µM à été préparée et cette fluorescence a été enregistrée pour le calcul de l’activité caspas-3 en terme de pmol AFC relâchés/minute/mg de protéine. Echelle d’analyse de l’apoptose du DNA: celle-ci a été réalisée sur les cellules HepG2 exposées à 15µg/ml et 0,1µg/ml respectivement de NPs de GNAs CO2 et ZnO soit diluées dans l’eau soit dans un amine « reteneur d’eau » pendant 24heures. A la fin de l’exposition le DNA a été extrait en utilisant le Kit Wako Echelle de détection d’Apoptose – Wako Chimical Industrie, Japon, Cat.N° ). Le DAN ectraita ensuite été analysé sur un gel à 1% d’agorose utilisant l’éthydium bromide. Le schéma de fragmentation de l’ADN aété documenté avec le gel système documentaire.
20 Dosage des paramètres oxydatifs: Les cellules HePG2 ont été cumltivées dans une flasque de 72cm² et exposée à des NPs de Gans CO2 et ZnO à des concentrations respectives de 15µg/ml et 0,1µg/ml soit diluées avec de l’eau soit un amine « rétenseur d’eau » pendant 24heures. Après le traiytement, les cellules ont été lavées et récoltées dans un tampon salé de phosphate à 4°. Les billes cellulaires récoltées ont amlors été lysées dans un tampon lyse (20nM-Tris-HCl [pH 7,5] , 150 mM NaCl, 1 mM Na2EDTA, 1% Triton, et 2,5mM pyrophosphate de sodium. S’en suit la centrifugation (10000*g pendant 10 minutes à 4°C) la partie surnageant ( extrait cellulaire) a été maintenu au froid jusqu’aux essais des biomarqueurs de stress oxydatif. L’extension de la membrane LPO a été estimée en mesurant la formation de malondialdehyde (MDA) en utilisant la méthode de Okhawa (Okhawa, Ohishi N, Yagi essai pour lipides peroxydes dans les tissus animaux par la réaction de l’acide thiobarbiturique. (Anal Biochem 1979; ). MDA est un des produits de la LPO de la membrane LPO (traducteur: lipîde peroxydation). Un mélange de 0,1 mL d’extrait cellulaire et 1,9mL de tampon phosphate de sodium (pH 7,4) fut incubé à 37° pendant 1heure. Le mélange incubé après précipitation avec 5% de TCA a été centrifugé ( 2300g 15 minutes à température de la pièce) et la partie surnageant a été récoltée. Ensuite, 1,0mL de 1% de TBA a été ajouté au liquide surnageant et placé dans de l’eau bouillante 15minutes. Après refroidissement à la température de la pièce, l’absorbance à été notée à 532nm et exprimée en nmol/mg protéine en utilisant le coefficient d’extinction moléculaire 1,56*105M-1cm-1. Le niveau GSHa été quantifié en utilisant le réactif de Hellman.
21 Efficacité anti cancer des Nano Particules de Gans CO2 et ZnO-in
Vitro
Dosage des paramètres de stress oxydatif-suite: le dosage du mélange consistait en un tampon de phosphate, DTNB, et extrait cellulaire. La réaction était monitorée à 412nm et la
somme de GSH était exprimée en terme de nmol/mg de protéines. L’activité de la dismutase superoxyde (DSO) a été estimée en employant la méthode citée plutôt. 35 Le dosage du mélange contenait un
tampon de sodium pyrophosphate, nitrobluetetrazolium (NBT), phénazine méthosulfate (PMS), nicotinamide adénine dinucléotide (NADH) et le volume requis d’extrait cellulaire. Une unité d’activité
d’enzyme SOD est définie comme la quantité d’enzyme requis pour inhiber la production chromogène (densité optique à 560nm) à 50% en 1 minute dans les conditions de dosage et exprimé comme
activité spécifique en unité/µg de protéines. L’activité catalase (CAT) a été mesurée selon ses capacités à rompre le peroxyde d’hydrogène (H2O2) en un temps d’incubation d’une minute. La
réaction a alors été stoppée le réactif dichromate/acétique et le restant d’(H2O2) a été déterminé par la mesure chromatique de l’acétate à 570 nm, qui est formé par la réduction de l’acide
dichromate/acétique en présence de H2O2, comme décrit précédemment. L’activité spécifique de CAT a été exprimée en unité/mg de protéines. L’activité de la réductase GSH a été mesurée en suivant
l’oxydation de NAPDH en NADP+ durant la réduction du GSH oxydé 5GSSG). L’activité GR a été exprimée en nmol NAPDH/minute/mg de protéine. L’activité de GSH peroxyde ( GPx) a été examinée par le
couplage de la réduction des peroxydes avec GSH et le recyclage de GSSG en GR en excès en utilisant NAPDH comme co-facteur. L’activité GPx a été exprimé en nmol/minute/mg de protéines.
22 Mesure du ROS intracellulaire: La production intracellulaire de ROS a été mesurée en utilisant 2,7- dychlorofluorecine diacétate ( DCFH-DA). Le DFSH-DA entre passivement dans la cellule où il réagit avec le ROS pour former le composé dichlorofluorecine (DCF) hautement fluorecent. En bref, une solution stock de10 mM de DCFH-DA (dans le méthanol) a été dilué dans le milmieu de culture sans sérum ou autre additif pour donner une solution de travail de 100µM. Les cellules HepG2 ont été traitée avec des NPs de Gans CO2 à une concentration de 15µg/mL et de Gans ZnO à une concentration de 0?1%g/mL soit dilué dans de l’eau soit dans avec des amines « contenant d’eau », pendant 24heures. A la fin de l’exposition, les cellules ont été lavées deux fois avec HBSS et ensuite incubées dans 1ml de solution de travail de DCFH-DA à 37° durant 30 minutes. Les cellules ont été lysées dans une solution alcaline pûis centrifugées à 2300g pendant 10mn. 200µl de liquide surnageant a été transféré dans 96 boites de cultures et la fluorescence a été mesurée a 435nm d’exitation et 520nm d’émission en utilisant un lecteur microplaque (MTP-900, Corona Electric, Papon). Les valeurs ont été exprimé en pourcentage d’intensité relative de fluorescence pour un bon contrôle. Estimation des protéines: Le contenu total des protéines a été mesuré en utilisant le Kit Wako d’essai rapide protéine (Wako Chemical Industrie, Japon, Cat. N° ). Et sérum albumine de bovin comme standard.
23 Milieu de culture Potentiel Zeta (-mV)
Résultats: Analyse des particules NPs de Gans CO2 et ZnO: La dimension hydrodynamique moyenne des NPs de CO2 dans l’eau et le milieu de culture cellulaire
déterminé par DLS était respectivement de 69nm et 65nm et la moyenne hydrodynamique des dimensions était respectivement de 118nm et 115nm. Ensuite, le potentiel Zeta de NPs de CO2 dans l’eau et
le milieu de culture était respectivement de 39,2V et 33,8V. EAU Milieu de culture Taille Hydrodynamique nm Potentiel Zeta (-mV)
24 Sélection des cellules cancéreuses tuées par les NPs de Gans: en 24h, 3 types de cellules (HepG2, A549, et BEAS-B2) et deux types de cellules de rats (astrocytes et hépatocytes) ont été exposées à des NPs de Gans CO2 dilué dans de l’eau à des concentrations de 5µg/mL, 10µg/mL et 15µg/mL; les NPS de Gans ZnO a été dilué dans de l’eau à des concentrations de 0,025µg/mL, 0,05µg/mL, 0,1µg/mL et dilué dans de l’amine « contenant d’eau » à la concentration de 0,1µg/mL. Au bout de 24h, leur toxicité a été déterminé en utilisant l’essai MTT. Les résultats montrent que les Gans de CO2 et de ZnO ci-dessous une concentration respectivement de 15µg/mL et 0,1µg/mL, n’ont pas montré de réduction significative de viabilité pour les 3 types de cellules (P<0,05 pour chacune). Alors que les concentrations respectives des NPs de Gans CO2 et ZnO ont augmenté à 15µg/mL et 0,1µg/mL une réduction significative de viabilité des cellules a étéb observé pour toutes les cellules cancéreuses à une dose de manière dépendante ( P<0,05) pendant que les NPs de Gans CO2 et de ZnO n’induisent pas de façon significative de réduction de la viabilité des astrocytes et hépatocytes primaires de rat à n’importe quelle concentration utilisée dans cette expérience. D’un autre côté 15µg/mL pour les NPs de CO2 et de 0,1µg/mL pour le ZnO dilués avec de l’amine « contenant d’eau » ne produit pas de réduction significative de la viabilité pour toutes les cellules cancéreuses pou dans la viabilité des cellules primaires astrocytes et hépatocytes (P< à 0,05 pour chaque)
25 Résultats: Mort sélective des cellules cancéreuses par les NPs de Gans-suite: Comme la concentration des NPs de Gans de CO2 augmente à 15µg/mL la viabilité des cellules a diminué significativement de 93%,99% et 97% pour les cellules BEAS-B2, HepG2,et A549 respectivement (P<0,05 pour chaque) et comme la concentration des NPs de Gans Zn0 a augmenté à O,1µg/mL, la viabilité des cellules cancéreuses à significativement diminué à 98%,99% et 99% pour les cellules BEAS-B2, HepG2 et les cellules A549 respectivement (P<0,05 pour chaque). Toutefois, de façon intéressante des concentrations seuil ont été observées. Ni les NPs de Gans CO2, ni les NPs de Gans Zno n’ont induite aucune réduction de la viabilité des cellules BEAS-B2, HepG2 et A549 jusqu’au maximum de concentration (15µg/mL pour les NPs de Gans CO2 et 0,1µg/mL pour les NPs de gans ZnO)
26 Mort sélective par les NPS de Gans de ZnO: L’effet des NPs de Gans ZnO sur la viabilité des 3 types de cellules ( HepG2, A459 et BEAS6B2) et deux types de cellules normales (astrocytes et hépatocytes de rat). Les cellules ont été traitées par NPs de Gans Zno dilué avec de l’eau à concentration de 0,025µg/mL, 0,05µg/mL et 0,1µg/mL par 24 heures. A la fin de l’exposition, la viabilité a été déterminé selon l’essai MTT. Les données ont montré une déviation +/- standard de trois expériences effectuées en triple.
27 Mort sélective par les NPS de Gans de CO2: L’effet des NPs de Gans CO2 sur la viabilité des 3 types de cellules ( HepG2, A459 et BEAS6B2) et deux types de cellules normales (astrocytes et hépatocytes de rat). Les cellules ont été traitées par NPs de Gans de CO2dilué avec de l’eau à concentration de 0,025µg/mL, 0,05µg/mL et 0,1µg/mL par 24 heures. A la fin de l’exposition, la viabilité a été déterminé selon l’essai MTT. Les données ont montré une déviation +/- standard de trois expériences effectuées en triple.
28 Les NPs de Gans CO2 et ZnO altèrent l’expression des niveaux de mRNA de l’apoptose des gène humains dans les cellules HepG2 du cancer du Foie. La quantité en temps réel PCR a été utilisé pour analyser les niveau du mRNA des gènes apoptotiques (p53, bax, bcl-2 et captase-3) dans les cellules HepB2 exposées aux NPS de Gans CO2 et ZnO dilués avec de l’eau ou des amine « contenant d’eau » à la concentration respective de 15µg/mL et 0,1µg/mL en 24h. Les résultats montrent que les deux NPs de GANS CO2 et ZnO altèrent de façon significative les niveaux d’expression du mRNA de ces gènes da ns les cellules HepG2. Le niveau d’expression mRNA du gène suppresseur tumoral P53 (FigA) et le gène bax propotonique (FigB) ont été régulés à la hausse (P<0,05 pour chaque)
29 Les NPs de Gans CO2 et ZnO altèrent l’expression du niveau de protéines des gènes apoptotiques dans les cellules HepG2 cancéreuses du foie: pour confirmer le résultat quantitatif en temps réel, nous avons examiné ultérieurement des niveaux de protéines des NPs des Gans CO2 et ZnO- exposé les cellules HepG2 en utilisant l’immuno buvardage. Similairement aux résultats mRNA, le niveau de protéine bax a été significativement évalué à la hausse tandis que l’expression de bcl-2 a été significativement évalué à la baisse à la fois pour les cellules traitées avec les NPs de Gans CO2 et ZnO (p<0,05) C D
30 Facteur
multiplicatif
Altération par les NPs de Gans CO2 et ZnO des niveaux d’expression des protéines des gènes apoptotiques des cellules cancéreuses HePG2 du foie ; Pour confirmer les résultats
quantitatifs PCR en temps réel, nous avons examiné ultérieurement l’expression des niveaux de protéines dans les NPs de Gans CO2 et ZnO, exposé les cellules HepG2 en utilisant l’immuno buvardage.
Similairement aux résultats mRNA, le niveau de protéines de p53 était significativement régulé à la hausse (P<0,05 pour chaque) Facteur multiplicatif
31 Les NPs de Gans CO2 et ZnO altèrent le niveau de protéines des gènes humain apoptotiques des cellules cancéreuses du Foie HepG2: Pour confirmer les résultats quantitatifs PCR en temps réel, nous avons examiné ultérieurement l’expression des niveaux de protéines dans les cellules HepG2 exposées au NPs de Gans CO2 et ZnO en utilisant l’immuno-buvardage. Similairement aux résultats mRNA, le niveau de protéine de bax était significativement régulé à la hausse tandis que l’expression de bcl-2 était significativement régulé à la baisse à la fois dans les cellules traitées aux NPs de Gans CO2 et ZnO (P<0,05 pour chaque)
32 Les NPs de aGans de CO2 et ZnO altèrent l’expression des niveaux de protéines des gènes apoptotiques humaines des cellules cancéreuse HepG2 du Foie: Pour confirmer les résultats PCR en temps réel, nous avons examiné ultérieurement l’expression des niveaux de protéines dans les cellules HepG2 exposées aux NPs de Gans CO2 et ZnO en utilisant l’immuno-buvardage. L’activité de l’enzyme caspase-2 était également significativement plus élevé à la fois dans les cellules exposées aux NPs de Gans CO2 et ZnO comparées aux cellules du groupe contrôle (p<0,05)
33 Les NPS de Gans CO2 et ZnO induisent une fragmentation apoptotique de l’ADN dans les cellules cancéreuses HepG2 du Foie. Le profile de l’ADN des cellules traitées avec 15µg/mL de NPs de Gans CO2 et 0,1µg/mL de ZnO pour 24 heures de même que les cellules contrôle non traitées ont été analysées. Dans le contrôle des cellules, l’ADN n’était pas fragmenté, tandis que les cellules traitées à la fois avec les NPS de Gans CO2 et ZnO dilués dans l’eau avaient commencé le processus d’apoptose comme il était évident avec la fragmentation de l’ADN, d’un autre côté alors que les cellules traitées avec les NPs de Gans CO2 et ZnO dilués avec de l’amine »reteneur d’eau » n’avaient pas induit de fragmentation apoptotique de l’ADN.
34 Les NPS de Gans CO2 et ZnO altèrent la balance oxydant/antioxydant des cellules HepG2 cancéreuses du Foie: Le statut des oxydants et antioxydants a été examiné dans les cellules cancéreuses HepG2 du Foie traitées avec 15µg/mL de NPs de Gans CO2 et 0,1µg/mL de NPS de Gans ZnO diluée soit avec de l’eau soit de l’amine « reteneur d’eau » pour 24 heures. Les niveaux ROS et LPO ont été mesurés avec des marqueurs des oxydants. Les résultats ont montré que les niveaux (ROS et LPO) ont été significativement plus élevés dans les cellules traitées alors que les NPs de Gans dilués avec le « reteneur d’eau » n’élevaient le niveau d’anti oxydants (P<0,05 pour chaque)
35 Les NPS de Gans CO2 et ZnO altèrent la balance oxydant/antioxydant des cellules HepG2 cancéreuses du Foie: Le statut des oxydants et antioxydants a été examiné dans les cellules cancéreuses HepG2 du Foie traitées avec 15µg/mL de NPs de Gans CO2 et 0,1µg/mL de NPS de Gans ZnO diluée soit avec de l’eau soit de l’amine « reteneur d’eau » pour 24 heures. Le statut anti oxydant a été examiné en déterminant GSH, SOD,CAT, GPx et GR. Les GANS CO2 et ZnO ont été dilués avec de l’eau respectivement à 15µg/mL et 0,1µg/mL ont induit une déplétion de GSH ainsi que la basse activité de l’enzyme anti oxydant GPx ( P<0,05 pour chaque)
36 Les NPS de Gans CO2 et ZnO altèrent la balance oxydant/antioxydant des cellules HepG2 cancéreuses du Foie: Le statut des oxydants et antioxydants a été examiné dans les cellules cancéreuses HepG2 du Foie traitées avec 15µg/mL de NPs de Gans CO2 et 0,1µg/mL de NPS de Gans ZnO diluée soit avec de l’eau soit de l’amine « reteneur d’eau » pour 24 heures. Le statut anti oxydant a été examiné en déterminant GSH, SOD,CAT, GPx et GR. Les GANS CO2 et ZnO ont été dilués avec de l’eau respectivement à 15µg/mL et 0,1µg/mL ont induit une déplétion de GSH ainsi que la basse activité de l’enzyme anti oxydant GR, SOD et CAT des cellules HepG2 (P<0,05 pour chaque)
37 Conclusion Nous avons observé que les deux NPS de Gans CO2 et ZnO ont des effets différents sur la viabilité des cellules mammaires en tuant les cellules cancéreuses ( HepG2, A549, et BEAS-28) en ne donnant aucun effet sur les cellules saines – astrocytes et hépatocytes du rat). La différence remarquée en toxicité sur cellules cancéreuse et cellules saines suggère un potentiel existant des NPs de Gans CO2 et ZnP comme nouvelles thérapies du cancer. Nos données moléculaires ont montré qu’à la fois le MRNA et le niveau de protéine du gène suppresseur tumoral p53 et du gène apoptotique bax étaient régulés à la hausse alors que le gène anti apoptotique bd-2 était régulé à la baisse sur les cellules HepG 2 cancéreuse du Foie traitées avec les deux NPs de Gans CO2 et ZnO. A la fois les NPs de Gans CO2 et ZnO se sont trouvés induire une activité de l’enzyme caspase-3 et une fragmentation de l’DAN des cellules HepG2. En outre à la fois les NPS de Gans CO2 et ZnO induisent des niveaux d’oxydants ( RSO et LPO) et réduisent les capacité d’antioxydant des cellules HepG2. Cette expérimentation suggère que les NPs de Gans l’apoptose des cellules cancéreuses avec comme médiateur ROS via p53 , bax/bcl-2 et par des voie caspase que la plupart des médicaments anti cancer déclenchant l’apoptose en n’ayant aucune toxicité pour les cellules saines. D’un autre côté, l’ajout d’une dilution avec l’amine « reteneur d’eau » diminue l’activité des nano particules. Note traducteur: HepG2= cellules cancéreuse hépatiques
38 Après injection, traitement de 20 jours
Efficacité anti cancer des particules de Gans CO2 et ZnO in Vivo- Test préliminaire Test préliminaire non contrôlé: 3g de NPs de
Gans de CO2 ont été mélangé avec 1 litre d’eau distillée pour former une solution. 1mL de solution a été injecté ( en sous cutané) dans chaque tumeur sur une base journalière. Résultats Après injection, traitement de 20 jours Avant
39 Matériel de test: Poudre en dispersion de NPs de Gans CO2 et ZnO, particules de dimension < 100nm ( dans H2O) synthétisée en accord avec la technique Keshe. Avant une administration orale ou nintra veineuse la dispersion a été diluée avec de l’eau distillée pour prévenir toute agglutination. Animaux de test: Souris Balb-c mâles et femelles âgés de huit à seize semaines (BW g) achetées chez CLEA Japon, Incorporated ( Tokyo, Japon). Les souris ont été placées par 2 dans une cage sous un cycle de lumière/noir de 12 heures avec un accès non limité à une nourriture pour souris et une eau à température ambiante. On leur a permis de s’acclimater à l’environnement une semaine avant traitement. Méthode expérimentale: Quarante des cinquante souris male et femelles rangées par poids (BW g) et âge ( 8 à 16 semaines) ont été implantés avec une portion médulaire de tumeur-25 de colon humain de 2mm par 2mm. Dix souris ont été conservé comme groupe contrôle et quarante souris ont été traitées oralement ou par intraveineuse avec du Gans CO2 ou un mélange de NPs de CO2/ZnO (w/w 1.3) en 4 groupes, dix souris par groupe. Les tumeurs exisées des souris donneuses ont été placées dans une solution de Ringer pour assurer la viabilité après extraction des donneuses. Les portions humidfiées de 2mm par 2mm ont été injectées sous l’épiderme en utilisant une aiguille de13.
40 Après traitement oral pendant 20 JOURS
Efficacité anti cancer des particules de Gans CO2 et ZnO in Vivo Avant Après traitement oral pendant 20
JOURS
41 Efficacité anti cancer des particules de Gans CO2 et ZnO in Vivo
Méthode traitement avec les NPS de Gans CO2 et ZnO: 3g de NPs de Gans CO2 et ZnO respectivement, ont été individuellement combinés avec un litre d’eau distillée pour former des
solutions. La solution de NPS Gans CO2 a été préparé en mélangeant 3 parts de Gans CO2 et une part de Gans ZnO pour produire une solution de 0,3 mg/ml . 1ml de ces
solutions a été administré oralement en utilisant une pipette type en plastique sur une base journalière ou par voie intraveineuse caudale ( le queue) ou en sous cutané dans la tumeur( doit être
décidé). La dose par voie orale ou intraveineuse ( ou sous cutané) débute au premier jour de palpation et se termine au 20ième jour après. Les souris sont réparties en
groupe contrôle et groupe test de la façon suivante: A- Les animaux contrôle recevront la dose de 1ml d’eau distillée B- Les souris test ( nourri
oralement) I: 1ml de solution de Gans CO2 II: 1ml de solution de Gans VCO2-ZnO ( w/w 3.1 en mélange respectif) fixé dans 10% de formol
C- Les souris test ( intra veineuse ou sous cutané) (doit être décidé) II: 1ml de solution de mélange de Gans C02 et ZnO (w/w 3.1 en mélange respectif
fixé dans 10% de formol)
42
Groupe BI , CO2 administration orale
Résultats Préliminaires: 2 des dix souris nourries en CO2 du groupe B I ont été sacrifiées et 2 des dix souris nourri en CO2 et ZnO du groupe B II. Groupe injection CI et C II en
cours. Groupe BI , CO2 administration orale Groupe BII, CO2 et ZnO administration orale Poids tumeur Taille tumeur Poids tumeur Taille tumeur